在过去的几十年中,外泌体因其在改变细胞功能中的作用而受到了广泛关注。外泌体是膜结合的纳米级囊泡,最初通过晚期核内体的内陷形成为特定的腔内囊泡群。由于晚期多泡内体与质膜融合,这些内体来源的腔内囊泡随后被释放到细胞外环境中,这是一种将它们与其他类型的细胞外囊泡区分开来的生物发生机制[1]。
因此,外泌体外膜由富含供体细胞膜衍生蛋白的磷脂双层和继承细胞质生物分子(包括蛋白质、酶、mRNA、miRNA 和代谢物)的水内核组成。外泌体的大小在 20-120 nm 之间,并且在形态和结构上因亲代细胞而异[2]。外泌体亚群呈现出不同的形状,从球形到丝状和细长形,还可以包括不同的子隔室[3]。

外泌体结构及形成过程
目前,已经开发了多种分离策略来从各种生物来源中离外泌体,这些生物来源包括牛奶、血液和尿液,以及植物衍生产品,例如水果和蔬菜。
外泌体利用多种内吞机制进入细胞。有趣的是,外泌体还可以克服物种障碍,在不同来源的细胞之间传递生物分子[4]。外泌体介导生物功能,从而调节体内重要的生理和病理过程[5]
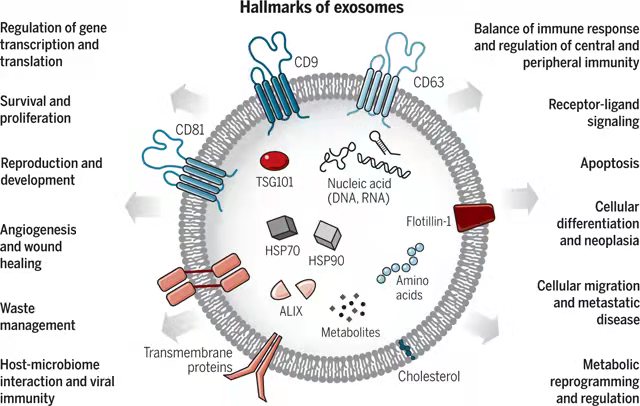
外泌体生物学功能
由于外泌体是内源性具有生物活性的生物分子的天然载体,它们已被广泛用于主动和被动传递合成生物分子。它们的内源性和纳米特性也使这些纳米载体能够跨越生物屏障,并赋予它们优良的生物相容性[6]。
因此,这几年各领域广泛展开外泌体相关的研究,外泌体研究横跨几乎所有的研究领域(免疫、神经系统、肿瘤、内分泌、循环系统等)。
然而,目前用于外泌体研究的实验技术仍处于开发阶段,许多问题仍有待改进。例如,外泌体纯化方法中,超速离心法和聚合物沉淀法(市售试剂盒)提取的外泌体中混有多种杂质,会给后续实验造成许多障碍。而抗体亲和法和密度梯度离心法这两种提取方法的问题在于,虽然可以提取到高纯度的外泌体,但外泌体结构不完整,无法用于分析外泌体的生理功能。
磷脂酰丝氨酸和Tim4新型外泌体提取法
外泌体膜虽然含有分泌细胞源蛋白质和脂质,但目前普遍认为在活细胞中磷脂酰丝氨酸(PS)通过脂质翻转酶作用定位于细胞膜内侧[7]。
作为通过巨噬细胞进行细胞凋亡的吞噬受体(T-cell immunoglobulin domain and mucin domain-containing protein 4,Tim4)蛋白通过细胞外域IgV域与结合了钙离子的PS结合[8]。
利用这一原理,Wako和金泽大学医学系免疫学华山教授共同开发一款划时代的外泌体提取方法,利用Tim4固化磁珠,在钙离子存在下捕捉培养上清和血清等样品中的外泌体,再添加螯合剂从而提取外泌体[9]。并且MagCapture™外泌体提取试剂盒PS实现了比传统的外泌体纯化法更加简单地提取高纯度完整状态的外泌体。
这是迄今为止取代黄金标准超速离心法的新型外泌体纯化法。
MagCapture™ 外泌体提取试剂盒PS
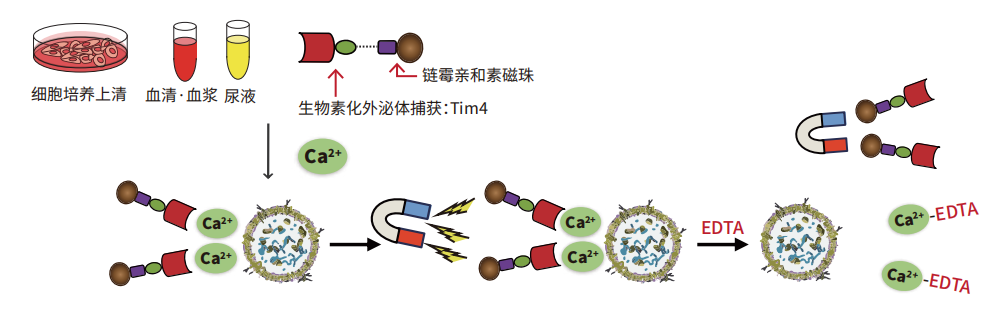
巨噬细胞表面的Tim4蛋白特异性结合细胞外囊泡表面的磷酯酰丝氨酸(PS)。
利用Tim4固化磁珠,在Ca2+ 存在条件下捕捉培养上清或血清等样本中的外泌体,通过使用含有EDTA的洗脱液洗脱,可获得高纯度的完整细胞外囊泡(EVs)。
01
原理
02
特点
● 可获得高纯度完整细胞外囊泡,可用于蛋白及核酸分析、共培养及体内注射
● 回收率高
● 操作简便(3.5h),不需超速离心

03
应用实例
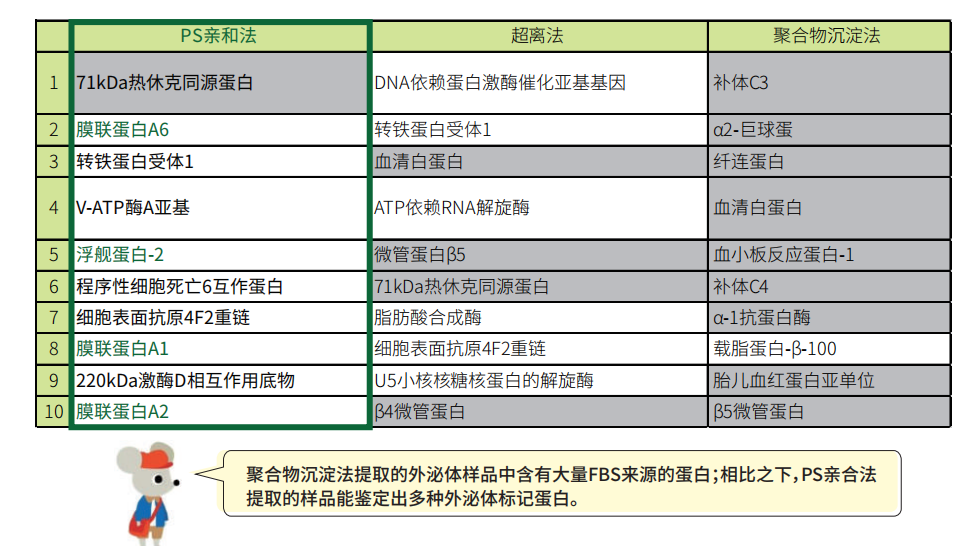
外泌体蛋白质组学分析
通过MASS鉴定结果比较丰度最高的前十种蛋白。
样品:K562细胞培养上清(含10%去外泌体FBS)
白色柱:源自外囊泡的人类蛋白
灰色柱:来自FBS的牛蛋白污染物
绿色:来自外囊泡的标记蛋白
产品数据来源:富士胶片和光(广州)贸易有限公司 http://labchem.fujifilm-wako.com.cn/pdf/show/152.html
图片来源:The biology, function, and biomedical applications of exosomes - PMC
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7717626/
[9] Nakai Wataru.et al. (2016). A novel affinity-based method for the isolation of highly purified extracellular vesicles. Sci Rep, 6, 33935.